El balanceo de las ecuaciones químicas es la forma de igualar la cantidad de átomos que reaccionan con los átomos que se producen en una ecuación química. En la ecuación química se muestran la fórmula de los materiales que reaccionan y los productos que se forman, separados por una flecha.
El balanceo de las ecuaciones químicas sirve para presentar de forma correcta las proporciones de sustancias que reaccionan y la cantidad de productos que se obtiene.
Para balancear una ecuación química, en primer lugar, debemos confirmar que el número de los átomos del lado izquierdo de la reacción es igual al lado derecho de los productos. De no ser así, podemos recurrir a algunos métodos para hacer el balanceo, como el de tanteo, algebraico y redox.
Por qué una ecuación química debe estar balanceada
Una ecuación química debe estar balanceada para ser correcta, de otra forma no presenta lo que sucede en la realidad.
Por ejemplo, el óxido de azufre SO3 da lugar al dióxido de azufre SO2 y al oxígeno molecular O2, como se muestra en la figura abajo:

Del lado izquierdo de la flecha se muestran los reactantes, tres átomos de oxígeno y un átomo de azufre. Del lado derecho de los productos hay cuatro átomos de oxígeno y uno de azufre. Esta ecuación no está balanceada pues tenemos un exceso de un oxígeno en los productos que va en contra de las leyes de la química y la física.
¿Cómo resolvemos este desequilibrio? Para balancear la ecuación química nos valemos de los coeficientes, unos números que colocamos delante de la fórmula química que nos indican cuantas moléculas participan en la reacción. El coeficiente delante de una fórmula multiplica al subíndice de cada átomo.
Por ejemplo, si colocamos un 2 delante del SO3 significa que son dos moléculas de óxido de azufre que están reaccionando entre sí. También significa que hay 2 átomos de azufre y 6 átomos (2x3) de oxígeno.
Un 2 delante del SO2 nos indica que se forman dos moléculas de dióxido de azufre, con 2 átomos de S y 6 átomos de O. Ahora tenemos la ecuación balanceada:

Métodos de balanceo de ecuaciones químicas
Existen varios métodos para balancear una ecuación química dependiendo de si son ecuaciones simples, ecuaciones redox o ecuaciones con muchos participantes.
Método de balanceo por inspección o tanteo
El método de balanceo por inspección o tanteo consiste en revisar elemento por elemento cuantos hay de cada lado de la flecha, y tratar de adivinar el coeficiente delante de las fórmulas hasta conseguir la igualdad. Algunas personas llaman a este método de ensayo y error.
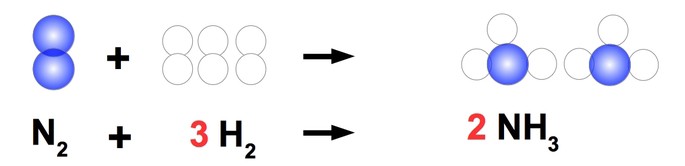
Por ejemplo, en la ecuación de formación del amoníaco a partir de nitrógeno e hidrógeno es la siguiente:

Esta ecuación no está balanceada porque hay dos átomos de nitrógeno y dos átomos de hidrógeno del lado izquierdo y un nitrógeno con tres hidrógenos del lado derecho.
Paso 1. Vamos a balancear al nitrógeno colocando un 2 delante del amoniaco NH3:

Paso 2. Vamos a balancear el hidrógeno. Tenemos dos H del lado izquierdo y 6 H del lado derecho (el coeficiente 2 multiplica al subíndice 3 del H; 2x3=6). Si colocamos un coeficiente 3 delante del H2 del lado izquierdo, habremos balanceado la ecuación:
Método algebraico de balanceo de ecuaciones químicas
El método algebraico utiliza la matemática para determinar los coeficientes delante de cada compuesto. Es útil cuando la ecuación química presenta muchos compuestos. Se hace de la siguiente forma:
Paso 1. Delante de cada fórmula química se coloca un coeficiente desconocido con las letras a, b, c, d, hasta cubrir todas las sustancias:
Paso 2. Ahora se elaboran sistemas de ecuaciones para cada elemento, de la siguiente forma:
El carbono del lado izquierdo tiene un subíndice 2 y el coeficiente a, y del lado derecho tiene un subíndice 1 y el coeficiente c
El hidrógeno del lado izquierdo está multiplicado por un subíndice 5 + 1 y por el coeficiente a, y esto debe ser igual al coeficiente d por el subíndice 2 del lado derecho:
El oxígeno del lado izquierdo es igual al coeficiente a por el subíndice 1 más el coeficiente b por el subíndice 2, mientras del lado derecho es igual a coeficiente c por el subíndice 2 más el coeficiente d:
Paso 3. Resolvemos el sistema de ecuaciones:
Paso 4. Le damos un valor a uno de los coeficientes y hacemos las sustituciones correspondientes. Si le damos al coeficiente a el valor de 1, tendremos que b=3, c= 2 y d=3. Sustituimos por los coeficientes numéricos y corroboramos el número de átomos:
Método de balanceo redox
Existen ecuaciones químicas que involucran el intercambio de electrones entre átomos. Estas reacciones se llaman de oxidación-reducción o reacciones redox. Como cualquier ecuación, el número de electrones tiene que ser igual del lado de los reactantes como del lado de los productos, es decir, los electrones no se crean ni se destruyen.
Paso 1. Revisar si la ecuación iónica está balanceada:
Parece que está balanceada pues hay un cobre Cu y un átomo de plata Ag de cada lado de la ecuación. Si nos fijamos bien, del lado de los reactantes hay un ion Ag+ con una carga positiva mientras que del lado de los productos hay un ion Cu2+ con dos cargas positivas. Esto significa que se perdió un electrón en el paso de reactantes a productos, lo que no está permitido en las reacciones químicas.
Paso 2. Igualar las cargas eléctricas colocando coeficientes en las fórmulas correspondientes de la siguiente manera:
De esta forma, del lado izquierdo hay 2 cargas positivas porque hay dos iones Ag+ mientras que del lado derecho hay dos átomos de Ag.
Vea también:
Ejercicios de balanceo de ecuaciones químicas
1. Balancea la siguiente ecuación donde el cobre (Cu) reacciona con ácido nítrico (HNO3) para formar nitrato de cobre (Cu(NO3)2), óxido de nitrógeno (NO) y agua (H2O):
2. Balancea la siguiente ecuación por el método algebraico de la reacción del nitrato de bismuto más sulfuro de sodio para formar sulfuro de bismuto y nitrato de sodio:
3. ¿Cuál de las siguientes ecuaciones no está balanceada? Balancéala.
4. Balancea la reacción redox entre el hierro Fe y el estaño Sn:
Vea también:
Referencias
Atkins, P., Jones, L., Laverman, L. (2016) Chemical Principles: the quest for insight. 7ed. W.H.Freeman. New York.
Kolb, D. (1978) The chemical equation Part I: simple reactions. J.Chemical Education 55:184
Tóth, Z. (1997) Balancing Chemical Equations by Inspection. J.Chemical Education 74: 1363