La ley de conservación de la materia significa que la materia no se crea ni se destruye sino que cambia. Esto quiere decir que la masa antes de la reacción química es igual a la masa después de la reacción.
Esta ley de la química también se le conoce como ley de conservación de la masa o ley de Lavoisier. En una reacción química, unas sustancias (reactantes) rearreglan sus átomos para dar origen a otras sustancias (productos).
Definición de la ley de conservación de la materia
"La masa de un sistema cerrado o aislado permanece invariable cualquiera que sea la transformación que ocurra dentro de él".
Un sistema cerrado es aquel donde no existe interacción con el entorno. En este sentido, dentro de un sistema cerrado no entran ni salen sustancias, pero se puede liberar energía. El sistema aislado, al igual que el cerrado, no hay entrada o salida de materia, pero tampoco hay transferencia de energía.
Aplicaciones de la ley de la conservación de la materia
La ley de la conservación de la materia fue un hito clave en el progreso de la química. Gracias a esto se puede establecer que las sustancias no desaparecen o se crean de la nada en una reacción química.
Balance de la ecuación química
La ecuación química muestra los participantes de la reacción química. Hablamos de una ecuación química balanceada cuando la cantidad de átomos del lado de los reactantes es igual al lado de los productos. Por ejemplo:
En esta reacción entre el carbonato de sodio y el cloruro de calcio, se produce cloruro de sodio y carbonato de calcio. En la tabla se muestran los átomos de los reactantes y de los productos;
| Elemento | Reactantes | Productos |
|---|---|---|
| Sodio (Na) | 2 | 2 |
| Carbono (C) | 1 | 1 |
| Calcio (Ca) | 1 | 1 |
| Oxígeno (O) | 3 | 3 |
| Cloro (Cl) | 2 | 2 |
Como podemos ver, los átomos de los reactantes son iguales a los átomos de los productos.
Predecir la masa de reactantes y productos
La conservación de la masa dice que la masa total de los reactantes debe ser igual a la masa total de los productos. Por ejemplo, en un recipiente cerrado tenemos 160 g de oxígeno y 68 g amoníaco NH3, que es igual a 228 g de reactantes. La reacción química que se produce es la siguiente:
Tendremos al final de la reacción la cantidad de 228 g de óxido nítrico (NO) y agua (H2) como productos.
Descubrimiento de la ley de conservación de la materia
Fue el científico ruso Mikhail Lomonosov (1711-1765) quien demostró por primera vez la conservación de la materia en 1756. Lo hizo al mostrar cómo unas placas de plomo no cambiaban de peso mientras se quemaban en un recipiente sellado (sin contacto con el aire). Lamentablemente, este hallazgo pasó desapercibido por muchos años.
Desde que comenzó su interés por la química, Antoine Laurent Lavoisier (1743-1794) reconoció la importancia de las medidas precisas. A él se le acredita la ley de conservación de la materia por sus estudios en combustión.
Lavoisier en uno de sus experimentos, hirvió agua por 101 días en un frasco especial, que condensaba el vapor de agua y lo regresaba al frasco. De esta forma, ninguna sustancia se perdía en el curso del experimento. Cuando comparó el peso del recipiente antes y después del período de hervido, eran iguales. Lavoisier de esta forma estableció que la masa no se creaba ni se destruía, sino que se trasformaba de una sustancia a otra.
Experimento fácil para demostrar la ley de conservación de la materia
Para este experimento necesitamos:
- bicarbonato de sodio (4gr)
- vinagre (10 ml)
- una balanza para pesar
- un frasco con boca ancha y tapa
- tubos de ensayo
Primera actividad
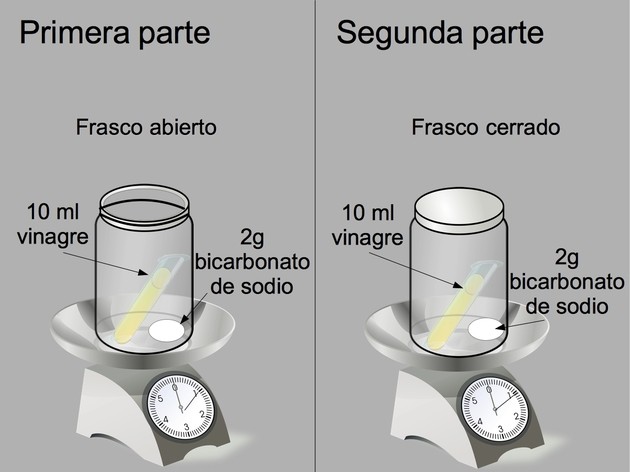
Sobre una balanza, colocamos un frasco de boca ancha con 2 gramos de bicarbonato de sodio y dentro de este un tubo de ensayo con 5 ml de vinagre. Pesamos y anotamos el valor. Luego derramamos el contenido del tubo de ensayo dentro del frasco. Cuando acaben las burbujas, anotamos el nuevo valor del peso.
Segunda actividad
Sobre la misma balanza, colocamos un frasco de boca ancha con 2 gramos de bicarbonato de sodio y dentro de este un tubo de ensayo con 5 ml de vinagre y cerramos el frasco. Pesamos y anotamos el valor. Luego tomamos el frasco y derramamos el contenido del tubo de ensayo en su interior. Cuando acaben las burbujas, anotamos el nuevo valor del peso.
Precaución: debido a la formación de gas (dióxido de carbono) aumenta la presión dentro del frasco cerrado. Se debe tener mucho cuidado al abrirlo, haciéndolo lentamente para que el gas se libere poco a poco.
Conclusión
El vinagre es ácido acético diluido. El ácido acético reacciona con el bicarbonato de sodio para formar acetato de sodio y dióxido de carbono, según la siguiente ecuación;
En la primera actividad, al reaccionar el vinagre con el bicarbonato de sodio, el dióxido de carbono se libera a la atmósfera ya que el frasco está abierto. En este caso el peso disminuye.
En la segunda actividad, se forma igual dióxido de carbono, pero como el frasco está tapado (sistema cerrado), el peso no cambia. De esta forma se demuestra que la materia no desaparece.
Vea también:
Ley de conservación de la materia y la energía
Albert Einstein estableció en su teoría de la relatividad especial:
"...la masa de un cuerpo es una medida de su contenido de energía..."
El contenido total de energía de un cuerpo puede calcularse multiplicando su cuerpo con la velocidad de la luz al cuadrado:
De acuerdo a esto, no hay distinción efectiva entre masa y energía: la energía y la masa son equivalentes. De hecho, la ley de la conservación de la materia deriva de la conservación de la energía. Si un cuerpo pierde energía también pierde masa; realmente esto no es pérdida, sino una transferencia al entorno.
Ejemplo
En la combustión de 342 g de azúcar común (sacarosa):
Se libera 5.635 kJ de energía. Esta cantidad de energía equivale a 6,269 x 10-11 kg, una cantidad extremadamente pequeña de masa difícil de medir con las técnicas actuales.
Vea también:
Ejercicios para aplicar la ley de conservación de la materia
Ejercicio 1
Al calentar 10 g de carbonato de calcio (CaCO3) se produce 4,4 g de dióxido de carbono (CO2) y 5,6 g de óxido de calcio (CaO). ¿Se cumple la ley de conservación de la masa en este experimento?
Solución: Tenemos que calcular las masas de los reactantes y la masa de los productos:
La masa de los productos es igual a 5,6g + 4,4g=10g.
Tenemos entonces, como es esperado, que 10 gramos de CaCO3 se transforman en 10 gramos de productos CaO y CO2.
Ejercicio 2
El amoníaco NH3 se produce por la reacción del nitrógeno y el hidrógeno:
¿Cuál es la cantidad de masa de amoníaco máxima que puede producir la mezcla de 1000 g N2 y 500 g de H2? ¿Cuál es la masa del material inicial que no reaccionó?
Solución: Según la ecuación de la reacción, 1 mol de nitrógeno reacciona con 3 moles de hidrógeno para dar 2 moles de amoníaco. Conociendo el peso molecular, calculamos cuanta masa de nitrógeno reacciona con hidrógeno. Un mol de N2 tiene una masa de 28 g, 3 moles de H2 tienen una masa de 6g.
Entonces 28 g de N2 reaccionan con 6 g de H2,1000 g de N2 reaccionarán con:
Luego, 1000 g de N2 más 214,20 g de H2 producen la cantidad máxima de 1214,20 g de amoníaco. Esto quiere decir que el material que no reaccionó fue el hidrógeno:
Ejercicio 3
En la siguiente reacción:
¿Cuál es la masa de flúor (F2) necesaria para producir 120 g de PF3? El peso atómico del fósforo P es 31 g/mol y el del flúor es 19 g/mol.
Solución: primero tenemos que verificar que la ecuación está balanceada. Hay 4 átomos de P en los reactantes y 1 átomo de P en los productos. Si colocamos un 6 delante del F2 y un 4 delante PF3, balanceamos la ecuación de la siguiente forma:
| Elemento | Reactantes | Productos |
|---|---|---|
| Fósforo (P) | 4 | 4 |
| Flúor (F) | 12 | 12 |
Ahora sabemos que 1 mol de P4 más 6 moles de F2 producen 4 moles de PF3, por lo tanto, 124 g de P4 más 228 g de F2 producen 352 g de PF3. Queremos saber cuánto de flúor se necesita para producir 120 g de trifluoruro de fósforo.
Respuesta: se necesita 77,7 g de F2 para producir 120 gr de PF3.
Vea también: