El agua es una molécula simple cuya importancia radica en su capacidad para servir como solvente de muchos compuestos. Compuesta de dos átomos de hidrógeno y uno de oxígeno, el agua es el único líquido inorgánico que ocurre naturalmente en la Tierra en los tres estados sólido, líquido, y vapor.
Importancia del agua en el planeta
El agua es la característica distintiva de la Tierra. La gran mayoría se encuentra en los océanos mientras apenas el 3% se encuentra repartido entre los cascos polares, los glaciares, el agua subterránea, lagos, ríos y suelo.
Los océanos cubren tres cuartas partes de la superficie terrestre. Además de ser los principales depósitos de agua y energía, también tienen influencia en el clima terrestre. Las corrientes cálidas oceánicas actúan como intercambiadores de calor, y son responsables del mantenimiento de la temperatura sobre la superficie de la tierra.
El vapor de agua en la atmósfera es de más de 60 mil billones de litros. Este vapor de agua tiene una gran influencia en el clima y como gas invernadero.
Importancia del agua para los seres vivos
La vida sobre la Tierra se originó muy probablemente en las aguas hirvientes de los océanos hace millones de años. En ese caldo primitivo, las moléculas primordiales reaccionaron y formaron las bases moleculares de los seres vivos.
La vida en el planeta depende del suministro de agua de una calidad aceptable y también en la regulación de la temperatura y la humedad del ambiente.
Las plantas requieren agua para la fotosíntesis y pierden agua por transpiración y evaporación. Los animales aseguran su suministro de agua a través de comida y bebida, el cual está balanceado por pérdida de agua debido a la sudoración, evaporación y excreción.
Ejemplos de la importancia del agua para los seres humanos
Los seres humanos no podemos vivir sin agua. Para todas las mayores actividades cotidianas que realizamos necesitamos de agua: alimentación, higiene, limpieza y entretenimiento.
Importancia del agua en la agricultura

La mayor necesidad de agua es la agricultura. Alrededor del 75% del uso de agua mundial es usada para producir comida. Algunas de las estrategias para mejorar el rendimiento del agua en la agricultura son:
- Desarrollar infraestructuras que aprovechen el almacenamiento y uso del agua de lluvia.
- Producir variedades agrícolas para hacerlas más resistentes a las sequías y a la salinidad.
- Mejorar el reciclaje y el almacenamiento de recursos hídricos.
- Promover prácticas agronómicas que usen eficientemente el agua.
Establecimientos humanos
Los seres humanos se han establecido cerca de fuentes de agua desde el inicio de los tiempos. La ingeniería del agua floreció durante el imperio Romano, con muchos acueductos construidos que aún permanecen en pie. En la edad media los molinos de agua se esparcieron por Europa.
Los primeros pobladores de la cuenca de México se establecieron alrededor de los lagos y establecieron el sistema de chinampa para producir alimentos.
Los seres humanos debemos cambiar nuestros estilos de vida de derroche de agua.
Vea también Contaminación.
Agua pura en medicina e industria

En hospitales, farmacéuticas y otros establecimientos médicos se requiere agua purificada de diferentes grados. El agua es el principal vehículo para las preparaciones de inyecciones hipodérmicas.
La industria de los electrónicos requiere agua ultra pura para la limpieza de las superficies de cristales. En la industria alimenticia el agua es un elemento imprescindible.
Estructura del agua
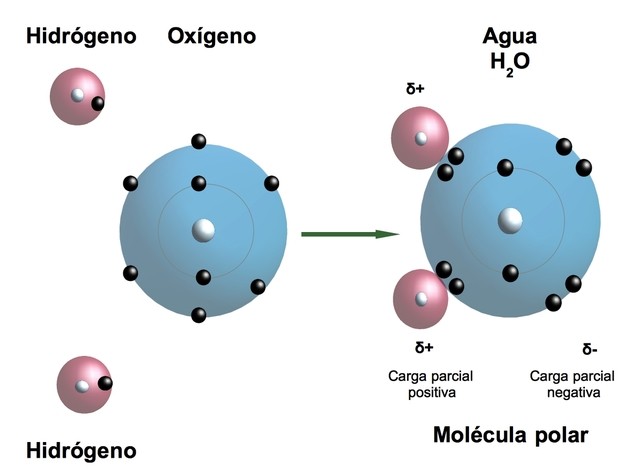
El peso molecular del agua es 18 gr/mol producto de un átomo de oxígeno y dos de hidrógeno. El oxígeno, que tiene seis electrones en su capa externa, al unirse a dos hidrógenos, se hace más estable con ocho electrones.
Los hidrógenos unidos al oxígeno forman un ángulo de 104,5º. El oxígeno tiene una atracción mayor por los electrones, lo que hace que la molécula del agua sea polar, es decir, tiene una región más rica en electrones (carga parcial negativa).
Los hidrógenos, con carga parcial positiva, son atraídos por las cargas parciales negativas de otras moléculas de agua, formando lo que se conoce como puentes de hidrógeno. Estos enlaces son la clave de las propiedades distintivas del agua.
En el estado sólido, las moléculas de agua están ordenadas de tal forma que un oxígeno está rodeado de cuatro átomos de hidrógeno: dos unidos covalentemente y dos hidrógenos que son atraídos por los electrones no compartidos del oxígeno.
En el estado gaseoso, las moléculas de agua se encuentran distanciadas e independientes de otras moléculas de agua.
Vea también Enlace covalente.
Propiedades físicas de importancia del agua
Aunque la molécula del agua es estructuralmente simple, sus propiedades físicas son más complicadas y poco comunes. A continuación presentamos las propiedades físicas del agua que han permitido el establecimiento de la vida sobre la tierra.
Capacidad calorífica
La cantidad de calor necesario para aumentar la temperatura de 14,5ºC a 15,5ºC de un gramo de agua se conoce como capacidad calorífica del agua, que es igual a 4,184 Joules. Esta capacidad es resultado de los enlaces de hidrógeno entre las moléculas de agua.
Gracias a esta gran capacidad calorífica, el agua tarda más en calentarse o enfriarse con respecto a otros líquidos. Esto ha permitido a los organismos vivos sobrevivir sin experimentar grandes cambios de temperatura. Los océanos son capaces de almacenar grandes cantidades de energía gracias a la gran capacidad calorífica del agua.
Calor latente
El calor latente es el calor obtenido por las moléculas de agua cuando pasan de líquido o sólido a gas sin que la temperatura varíe. En el caso del hielo que se derrite, el calor latente de fusión del agua a 0 ºC es de aproximadamente 334 joules por gramo, y el calor latente de evaporación del agua a 100 ºC es de 2230 joules por gramo.
Densidad
La densidad del agua es la relación de la masa de agua con respecto a su volumen. A 4 ºC el agua alcanza la mayor densidad de 1 gr/cm3 mientras que por encima o por debajo es de 0,99 gr/cm3, esto significa que el agua líquida es 10% más densa que el hielo, por eso el hielo flota.
El hielo que se forma en lagos y otros depósitos naturales de agua en las zonas frías de la Tierra actúa como aislante, lo que permite la vida de las formas acuáticas en estas zonas.
Solubilidad
El agua es considerada el solvente universal, ya que en ella se pueden disolver muchos más compuestos que en otro líquido. Los compuestos iónicos y polares, es decir que tienen cargas, interactúan con las moléculas de agua. Por ejemplo, las sales, como el cloruro de sodio o el sulfato de magnesio son compuestos iónicos, mientras que la glucosa y el alcohol son compuestos polares.
Los lípidos y grasas son hidrofóbicos, es decir, no son solubles en agua.
Propiedades cohesivas y adhesivas
Las propiedades cohesivas del agua explican la tensión superficial. Esta es la capacidad de una sustancia de mantener sus moléculas unidas cuando experimentan un estrés o tensión. Es por esta propiedad que objetos como agujas o pequeños insectos pueden posarse sobre la superficie del agua sin hundirse.
Por otro lado, la propiedad adhesiva del agua se refleja en la capilaridad. Es la atracción entre moléculas de agua y otras moléculas, como se observa en las paredes de un tubo de vidrio.
Las propiedades adhesivas y cohesivas son fundamentales en el transporte de agua desde las raíces hasta las hojas de las plantas.
Vea también Propiedades del agua.
Bioquímica del agua
El agua no solo es un solvente donde se producen las reacciones químicas. Funciona como lubricante y líquido de limpieza, transporta nutrientes y productos de desecho. También participa en varias reacciones bioquímicas: oxidación, reducción, condensación e hidrólisis. La oxidación de agua a oxígeno constituye una de las reacciones componentes importantes de la fotosíntesis:
Se produce agua a través de la combustión de la glucosa en la mitocondria:
Agua como un recurso esencial

Menos del 3% del agua fresca disponible en el mundo se encuentra en ríos y lagos. El agua subterránea es de creciente importancia como fuente de suministro. El mantenimiento y calidad de las reservas de agua subterránea están relacionadas al uso y tratamiento de la tierra.
Uno de los problemas crecientes es la salinización del agua subterránea, debido a la evaporación de aguas de baja calidad.
Por otro lado, la conversión de agua de mar a agua fresca puede no ser atractiva económicamente en la actualidad, pero el mejoramiento de procesos acoplado con la necesidad hará esta una opción práctica.
Algunas propuestas para mitigar el problema de agua en ciertas regiones es remolcar icebergs desde los cascos polares. Países como Sudáfrica y los Emiratos Árabes Unidos enfrentan una escasez de agua muy seria y esta podría ser una solución de ser posible.
Vea también